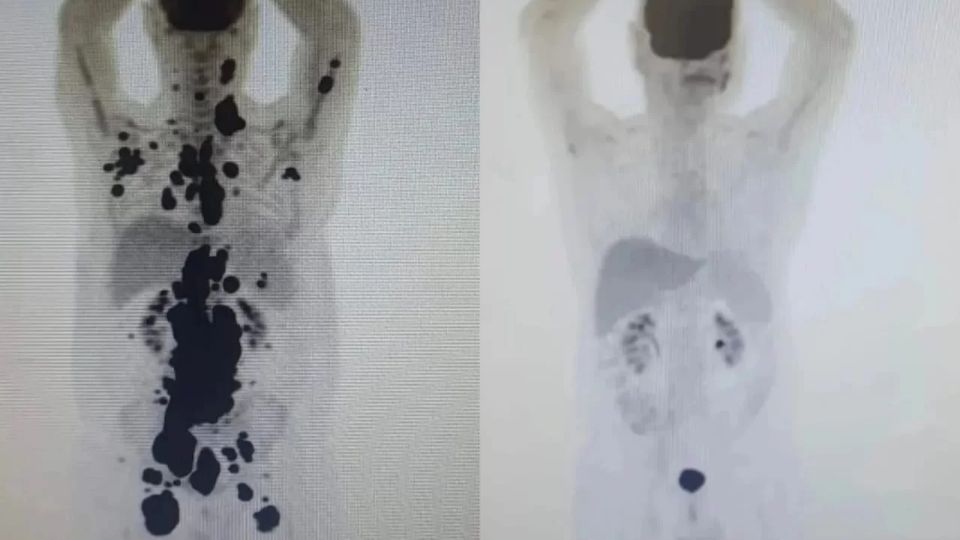
Nesta terça-feira (26), a Agência Nacional de Vigilância Sanitária (Anvisa) autorizou a realização de um ensaio clínico no Brasil para testar um medicamento especial à base de células geneticamente modificadas, chamadas células CAR-T. A autorização foi concedida à Fundação Hemocentro de Ribeirão Preto (FUNDHERP), em parceria com o Instituto Butantan.
O objetivo do estudo é verificar a eficácia e a segurança do tratamento para leucemia linfóide aguda B e linfoma não Hodgkin B. Ele está em fase inicial e é voltado para aqueles pacientes que estão vivenciando um reaparecimento das doenças ou uma resistência aos tratamentos padrão.
Te podría interesar
A Anvisa afirma que “a aprovação desse ensaio clínico é parte de um projeto inovador de colaboração regulatória” entre a agência e pesquisadores e desenvolvedores brasileiros. “O objetivo é impulsionar o desenvolvimento de produtos de terapias avançadas disponíveis no Sistema Único de Saúde (SUS)”, explicou em nota oficial.
O que são as Células CAR-T
O tratamento com Células CAR-T age de modo a reprogramar as células do paciente para atacar e destruir o câncer de forma precisa. Isso se dá através da transferência, em laboratório, de genes de interesse para as células de defesa do paciente, isto é, os linfócitos T.
Te podría interesar
O uso e as pesquisas com CAR-T são voltados ao tratamento de cânceres hematológicos, aqueles originários das células sanguíneas, como linfomas, mielomas e leucemia. Para o estudo clínico da FUNDHERP, o foco está na leucemia linfóide aguda B e no linfoma não Hodgkin B.
Em maio deste ano, a técnica CAR-T ficou famosa ao levar um paciente com câncer em estágio terminal à remissão em apenas um mês. Paulo Peregrino, de 61 anos, combatia um linfoma há 13, quando foi tratado pela terapia em São Paulo.
Como funcionará o novo estudo
Foram 104 dias de avaliação documental realizada pela Anvisa e 144 dias de respostas às exigências trabalhadas pela FUNDHERP até que o novo estudo clínico fosse autorizado.
Após sua aprovação, a Anvisa criou um plano de acompanhamento, com ações planejadas até dezembro de 2024. Haverá revisões frequentes dos dados e informações da pesquisa. A ideia é monitorar de perto o desenvolvimento do produto.
Se os resultados forem positivos, a Anvisa afirma que o produto será rapidamente registrado “para que as pessoas tenham acesso a uma opção de tratamento segura, eficaz e de alta qualidade disponível no SUS”.
“A experiência recente no Brasil e no mundo tem mostrado que quando os pesquisadores e a Anvisa trabalham juntos desde o começo, isso pode resultar em dados científicos melhores em termos de segurança, eficácia e qualidade. Isso, por sua vez, pode acelerar o acesso da população a novas tecnologias em saúde”, explicou a Agência.